Hướng dẫn thu hồi, xử lý thuốc vi phạm
 |
| Thuốc phải tiêu hủy khi hết hạn dùng, bị hư hỏng trong quá trình sản xuất, bảo quản, vận chuyển... |
Thông tư này hướng dẫn chi tiết việc áp dụng tiêu chuẩn chất lượng thuốc (thuốc hóa dược, thuốc dược liệu, vắc xin, sinh phẩm), nguyên liệu làm thuốc (trừ dược liệu, vị thuốc cổ truyền); việc kiểm nghiệm thuốc, nguyên liệu làm thuốc, bao bì tiếp xúc trực tiếp với thuốc và quy trình thu hồi, xử lý thuốc vi phạm.
Quy trình thu hồi thuốc theo hình thức bắt buộc
Thông tư quy định, quy trình thu hồi thuốc theo hình thức bắt buộc như sau:
1- Tiếp nhận thông tin về thuốc vi phạm của Bộ Y tế (Cục Quản lý Dược)
Thông tin đánh giá thuốc không bảo đảm hiệu quả điều trị, tính an toàn của Hội đồng tư vấn đăng ký thuốc hoặc Hội đồng tư vấn về xử lý tai biến sau tiêm chủng vắc xin. Thông tin về chất lượng thuốc không đạt từ cơ sở kiểm nghiệm thuốc.
Thông tin về thuốc vi phạm do Cục Quản lý Dược, Cơ quan thanh tra phát hiện. Thông báo về thuốc vi phạm của cơ sở sản xuất, cơ quan quản lý, cơ quan kiểm tra chất lượng nhà nước về thuốc của nước ngoài.
Thông tin về thuốc vi phạm (bao gồm cả thuốc giả, thuốc không rõ nguồn gốc) do cơ quan công an, hải quan, quản lý thị trường phát hiện.
2- Tiếp nhận thông tin về thuốc vi phạm của Sở Y tế tỉnh, thành phố trực thuộc Trung ương
Thông tin về thuốc không đạt tiêu chuẩn chất lượng từ cơ sở kiểm nghiệm thuốc.
Thông tin về thuốc vi phạm do Cục Quản lý Dược, Cơ quan thanh tra phát hiện trên địa bàn.
Thông tin về thuốc vi phạm (bao gồm cả thuốc giả, thuốc không rõ nguồn gốc) do cơ quan công an, hải quan, quản lý thị trường thuộc địa bàn tỉnh, thành phố phát hiện.
3- Xác định mức độ vi phạm
Trong thời hạn 24 giờ, kể từ thời điểm tiếp nhận thông tin về thuốc vi phạm, Bộ Y tế (Cục Quản lý Dược), Sở Y tế tiến hành xác định mức độ vi phạm của thuốc và kết luận về việc thu hồi thuốc vi phạm trên cơ sở đánh giá nguy cơ đối với sức khỏe của người sử dụng, kể cả trong trường hợp có khiếu nại về kết quả kiểm nghiệm.
4- Xử lý của Sở Y tế đối với thuốc vi phạm trên địa bàn
Trong thời hạn 24 giờ, kể từ thời điểm tiếp nhận được thông tin về thuốc vi phạm, Sở Y tế đối chiếu mức độ vi phạm của thuốc được quy định tại Phụ lục II ban hành kèm theo Thông tư này và có văn bản xử lý, thu hồi thuốc trên địa bàn đối với thuốc vi phạm mức độ 2 hoặc mức độ 3 theo quy định tại Điều 14 của Thông tư này.
Kiểm tra, giám sát việc thu hồi, lấy mẫu thuốc để kiểm tra chất lượng thuốc trên địa bàn.
5- Xử lý của Bộ Y tế (Cục Quản lý Dược) đối với thuốc vi phạm:
Trong thời hạn không quá 24 giờ, kể từ thời điểm kết luận về việc thu hồi thuốc đối với các trường hợp vi phạm theo quy định tại khoản 1 Điều 65 của Luật Dược, Bộ Y tế (Cục Quản lý Dược) ban hành quyết định thu hồi thuốc.
Quyết định thu hồi phải bao gồm các thông tin sau (nếu có): tên thuốc, số giấy đăng ký lưu hành hoặc số giấy phép nhập khẩu, tên hoạt chất, nồng độ, hàm lượng, dạng bào chế, số lô, hạn dùng, cơ sở sản xuất, cơ sở nhập khẩu, mức độ thu hồi, cơ sở chịu trách nhiệm thu hồi thuốc.
Thuốc thu hồi theo quyết định thu hồi do Bộ Y tế (Cục Quản lý Dược) ban hành được xác định là lô thuốc hoặc nhiều lô thuốc hoặc toàn bộ các lô thuốc của một hoặc nhiều thuốc.
6- Thông báo quyết định thu hồi thuốc.
7- Triển khai thu hồi thuốc.
Xử lý thuốc vi phạm
Theo Thông tư, thuốc vi phạm được phép khắc phục hoặc tái xuất trong trường hợp sau:
- Thuốc vi phạm mức độ 3 và không thuộc trường hợp quy định tại điểm đ và e khoản 1 Điều 17 của Thông tư này (Thuốc bị thu hồi do vi phạm mức độ 3, được Bộ Y tế (Cục Quản lý Dược) xem xét theo quy định và kết luận không thể khắc phục, tái xuất được; thuốc bị thu hồi do vi phạm mức độ 3 được Bộ Y tế (Cục Quản lý Dược) cho phép khắc phục hoặc tái xuất nhưng cơ sở không thực hiện được việc khắc phục, tái xuất).
- Thuốc vi phạm quy định về ghi nhãn, tờ hướng dẫn sử dụng.
- Thuốc đóng gói trong bao bì ngoài từ các thuốc thành phần được đóng gói trong bao bì trực tiếp khác nhau (bộ kít) mà một hoặc một số thuốc thành phần không đạt tiêu chuẩn chất lượng. Căn cứ mức độ vi phạm của thuốc thành phần, thì thuốc thành phần này được phép tái chế, tái xuất hoặc hủy bỏ theo quy định. Các thành phần khác đạt tiêu chuẩn chất lượng được phép tái chế, đóng gói lại phù hợp.
Quy trình đề nghị khắc phục thuốc bị thu hồi
Cơ sở có thuốc bị thu hồi đề nghị khắc phục có văn bản gửi Bộ Y tế (Cục Quản lý Dược) kèm theo quy trình khắc phục, đánh giá nguy cơ đối với chất lượng, độ ổn định của thuốc, chương trình theo dõi, giám sát chất lượng, an toàn, hiệu quả của thuốc trong quá trình lưu hành.
Trong thời hạn tối đa 60 ngày, kể từ ngày nhận được văn bản đề nghị khắc phục của cơ sở, Bộ Y tế (Cục Quản lý Dược) phải xem xét, có ý kiến trả lời bằng văn bản đồng ý hoặc không đồng ý việc khắc phục. Trường hợp không đồng ý phải nêu rõ lý do.
Trường hợp cần bổ sung hoặc làm rõ thông tin liên quan đến việc khắc phục, trong thời hạn tối đa 60 ngày, kể từ ngày nhận được văn bản của Bộ Y tế (Cục Quản lý Dược), cơ sở phải nộp tài liệu bổ sung, giải trình. Sau thời hạn trên, cơ sở không nộp tài liệu bổ sung, giải trình thì đề nghị khắc phục không còn giá trị.
Quy trình đề nghị tái xuất thuốc thu hồi
Cơ sở có thuốc bị thu hồi, thuốc vi phạm có văn bản gửi Bộ Y tế (Cục Quản lý Dược) kèm theo phương án tái xuất nêu rõ thời gian và nước tái xuất.
Trong thời hạn tối đa 15 ngày, kể từ ngày nhận được văn bản đề nghị của cơ sở, Bộ Y tế (Cục Quản lý Dược) có ý kiến trả lời bằng văn bản đồng ý hoặc không đồng ý tái xuất; trường hợp không đồng ý phải nêu rõ lý do.
Việc khắc phục, tái xuất thuốc bị thu hồi chỉ được thực hiện sau khi có ý kiến đồng ý bằng văn bản của Bộ Y tế (Cục Quản lý Dược).
Hủy thuốc
1- Thuốc phải tiêu hủy khi thuộc một trong các trường hợp sau đây:
a ) Thuốc hết hạn dùng; b) Thuốc bị hư hỏng trong quá trình sản xuất, bảo quản, vận chuyển; c) Thuốc là mẫu lưu đã hết hạn thời gian lưu mẫu theo quy định; d) Thuốc bị thu hồi do vi phạm mức độ 1 hoặc mức độ 2; đ) Thuốc bị thu hồi do vi phạm mức độ 3, được Bộ Y tế (Cục Quản lý Dược) xem xét theo quy định và kết luận không thể khắc phục, tái xuất được;
e) Thuốc bị thu hồi do vi phạm mức độ 3 được Bộ Y tế (Cục Quản lý Dược) cho phép khắc phục hoặc tái xuất nhưng cơ sở không thực hiện được việc khắc phục, tái xuất; g) Thuốc giả, thuốc nhập lậu, thuốc không rõ nguồn gốc, xuất xứ, thuốc có chứa các chất bị cấm sử dụng; h) Thuốc thuộc trường hợp phải bị tiêu hủy theo quy định tại Nghị định về xử phạt hành chính trong lĩnh vực y tế; i) Thuốc sản xuất từ nguyên liệu không đạt tiêu chuẩn chất lượng, trừ trường hợp chỉ tiêu không đạt được xử lý trong quá trình sản xuất và không ảnh hưởng tới quy trình sản xuất và chất lượng thuốc.
2- Hủy thuốc tại cơ sở sản xuất, nhập khẩu, bán buôn, cơ sở kiểm nghiệm thuốc, bệnh viện, viện có giường bệnh:
Người đứng đầu cơ sở sản xuất, nhập khẩu, bán buôn, cơ sở kiểm nghiệm thuốc, bệnh viện, viện có giường bệnh có thuốc bị tiêu hủy ra quyết định thành lập Hội đồng hủy thuốc để tổ chức việc hủy thuốc, quyết định phương pháp hủy, giám sát việc hủy thuốc. Hội đồng có ít nhất 03 người, trong đó phải có 01 đại diện là người phụ trách chuyên môn của cơ sở.
Việc hủy thuốc phải đảm bảo an toàn cho người, súc vật và tránh ô nhiễm môi trường theo các quy định của pháp luật về bảo vệ môi trường.
Cơ sở có thuốc bị tiêu hủy phải chịu toàn bộ trách nhiệm liên quan đến việc hủy thuốc. Có báo cáo kèm theo biên bản hủy thuốc gửi tới Sở Y tế sở tại đối với các trường hợp hủy thuốc. Biên bản hủy thuốc theo quy định tại mẫu số 06 Phụ lục III ban hành kèm theo Thông tư này.
3- Quy định về việc hủy vắc xin
Trước khi thực hiện hủy vắc xin ít nhất 07 ngày làm việc, cơ sở có vắc xin bị tiêu hủy phải có văn bản thông báo kế hoạch hủy đến Sở Y tế sở tại, trong đó phải có các thông tin về tên, số lượng, nồng độ hoặc hàm lượng của từng vắc xin cần hủy, lý do xin hủy, thời gian hủy, địa điểm hủy và phương pháp hủy. Sở Y tế có trách nhiệm giám sát việc hủy vắc xin.
Quy trình hủy vắc xin và việc hủy vắc xin phải được thực hiện theo đúng các quy định hiện hành về quản lý chất thải y tế, quản lý chất thải nguy hại. Cơ sở có vắc xin bị tiêu hủy có văn bản báo cáo việc hủy vắc xin kèm theo biên bản hủy tới Sở Y tế sở tại và Cục Quản lý Dược. Biên bản hủy vắc xin theo quy định tại mẫu số 06 Phụ lục III ban hành kèm theo Thông tư này.
4- Việc hủy thuốc phải kiểm soát đặc biệt phải thực hiện theo quy định tại Điều 37 của Nghị định số 163/2025/NĐ-CP.
5- Hủy thuốc tại cơ sở bán lẻ, phòng khám chữa bệnh: Việc hủy thuốc thực hiện theo hợp đồng với cơ sở có chức năng về xử lý rác thải công nghiệp.
Người chịu trách nhiệm chuyên môn của cơ sở bán lẻ, người đứng đầu phòng khám chữa bệnh chịu trách nhiệm về việc hủy thuốc, giám sát việc hủy thuốc; lưu trữ tài liệu về việc hủy thuốc.
6- Thời hạn xử lý thuốc bị thu hồi không quá 12 tháng kể từ thời điểm hoàn thành việc thu hồi theo quy định tại các điểm a, b và c khoản 3 Điều 63 của Luật Dược.
Các tin khác
Chủ nhật Đỏ 2026: Nhịp cầu nhân ái kết nối những giọt máu cứu người

Đưa Trung tâm hồi sức tích cực, chống độc hiện đại phục vụ bệnh nhân

Ký kết hợp tác chuyên môn giữa Bệnh viện Đa khoa Khánh Hoà và BVĐK Sài Gòn Nha Trang
Không chủ quan với bệnh cúm mùa

Hội thảo cập nhật kỹ thuật mới trong điều trị ung thư gan và phẫu thuật thị phạm thành công ca bệnh phức tạp

Chuẩn bị công tác y tế phục vụ Đại hội Đảng toàn quốc lần thứ XIV
Chính thức đưa tiêm chủng chiến dịch chủ động vào Luật

Hơn 2.000 phụ nữ yếu thế được tầm soát miễn phí ung thư nguy hiểm

Bệnh viện Đa khoa Khánh Hòa: Ký kết hợp tác hỗ trợ chuyên môn trong lĩnh vực tim mạch – tim mạch can thiệp
Đọc nhiều

Cờ Đỏ phát huy nội lực, tạo nền tảng phát triển bền vững

Đoàn Luật sư TP. Cần Thơ: 35 năm đồng hành bảo vệ công lý, kiến tạo môi trường pháp lý bền vững

Đưa Trung tâm hồi sức tích cực, chống độc hiện đại phục vụ bệnh nhân

Mega Sale 2026 lan tỏa xu hướng tiêu dùng xanh tại Cần Thơ

Những kỳ tích y khoa đầu năm 2026 tại Bệnh viên Đa khoa vùng Tây Nguyên
Videos
E-magazine Inforgraphic Video

Diễn văn của Tổng Bí thư Tô Lâm tại phiên bế mạc Đại hội XIV của Đảng

Đại hội XIV của Đảng sự kiện trọng đại của đất nước trong giai đoạn mới

Hợp tác xã bệ đỡ vùng trồng rau an toàn tập trung tại Hưng Yên

Hưng Yên sản xuất rau quả công nghệ cao hướng đi bền vững cho nông nghiệp sạch

Xã Ô Diên – Hà Nội: Bất cập từ bãi vật liệu xây dựng gây ô nhiễm môi trường và trách nhiệm quản lý tại địa bàn cơ sở

Cảnh báo hành vi giả danh cán bộ thuế, cơ quan thuế để lừa đảo
Phòng ngừa cháy nổ trong dịp Tết Nguyên đán

Bản tin tổng hợp số 8 tháng 11 của Tạp chí Sức khoẻ & Môi trường

Hà Nội (Q.Hà Đông) : Môi trường sống của người dân không được đảm bảo bởi những công trình vi phạm TTXD

Những kỳ tích y khoa đầu năm 2026 tại Bệnh viên Đa khoa vùng Tây Nguyên

Lần đầu tiên ban hành phác đồ kết hợp y học cổ truyền và hiện đại cho 16 bệnh phổ biến

Bệnh viện Đa khoa Thiện Hạnh đón nhận 2 chứng chỉ ISO quốc tế - Khẳng định chuẩn hóa quản lý chất lượng y tế tại khu vực Tây Nguyên

Bệnh viện K ghi dấu bước tiến quan trọng trong điều trị ung thư phụ khoa

Tác hại của dầu chiên khi sử dụng nhiều lần

Trung tâm Y tế khu vực Yên Lạc tổ chức Hội thi “Phụ nữ với công tác Dân số và Phát triển” năm 2025

Chi cục An toàn thực phẩm tỉnh Phú Thọ: Nâng cao nhận thức trách nhiệm toàn xã hội về an toàn thực phẩm

Chi Cục An toàn thực phẩm Phú Thọ: Tập huấn tăng cường năng lực về quản lý an toàn thực phẩm cho Ban Chỉ đạo liên ngành ATTP xã, phường

Nghiên cứu ứng dụng D-Panthenol và hệ nền sinh học: Bước tiến mới của DUYENTHI GROUP trong phục hồi hàng rào bảo vệ da

Hành trình khởi nghiệp của sinh viên Y Dược Cần Thơ

Bộ Y tế thu hồi dược liệu Ý dĩ không đạt tiêu chuẩn chất lượng

Bộ Y tế cấp mới, gia hạn giấy đăng ký lưu hành gần 800 loại thuốc

Nguy cơ xâm nhập biến chủng Omicron vào Việt Nam là rất lớn

Giải pháp thích ứng với vi rút corona

Thủ tướng ký ban hành Nghị quyết về mua vắc-xin Covid-19

Rửa tay là biện pháp hàng đầu phòng bệnh tay chân miệng
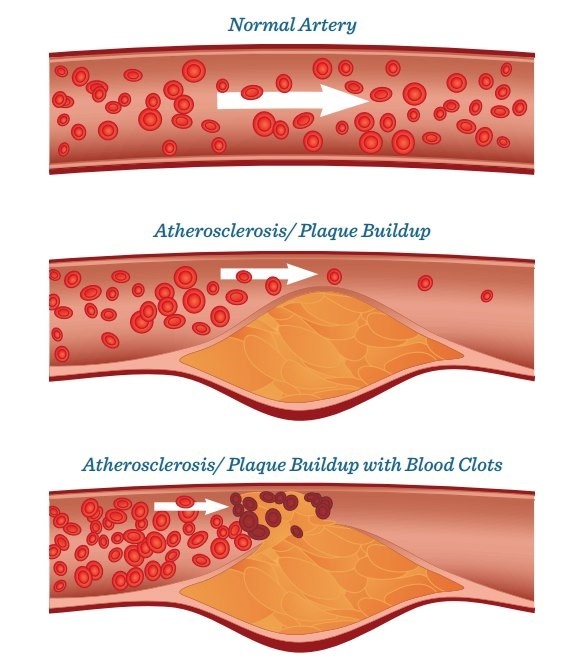
Phòng ngừa bệnh tim quá đơn giản: đánh răng!

Nữ thầy thuốc giỏi chuyên môn, nhiệt huyết với phong trào
Bệnh viện Đa khoa Trung ương Cần Thơ: Sử dụng hệ thống dao mổ siêu âm Cusa trong phẫu thuật cắt gan

Tiến sĩ, bác sĩ, Thầy thuốc Nhân dân Trương Tấn Minh luôn hết lòng vì sự nghiệp y tế

Không để tình trạng ứng phó thụ động, bất ngờ với COVID-19

An Giang tăng cường kiểm soát, ngăn chặn bệnh cúm gia cầm

Bộ Y tế đã cấp phép, gia hạn hơn 13.500 số đăng ký thuốc, vaccine, sinh phẩm

BVĐK tỉnh Khánh Hoà: Điều trị thành công ca rò động mạch cảnh xoang hang bằng kỹ thuật can thiệp nội mạch thần kinh
Nổi bật

Cần Thơ mời gọi Sumitomo đầu tư hạ tầng khu công nghiệp, đô thị bền vững

Lan tỏa tinh thần nhân ái tiếp sức tương lai cho trẻ em khuyết tật

Bệnh viện Phụ sản Trung ương tổ chức Hội nghị tổng kết công tác chỉ đạo tuyến chuyên ngành phụ sản khu vực phía Bắc

Hà Nội thông qua chủ trương đầu tư nhiều dự án quan trọng

Tổng Bí thư Tô Lâm hội đàm với Tổng Bí thư, Chủ tịch nước Lào Thongloun Sisoulith

Hơn 30 chuyên gia từ Mỹ và Anh khám từ thiện cho bệnh nhân nghèo

TTYT huyện Yên Lạc: Đẩy mạnh cải cách hành chính hướng tới sự hài lòng người bệnh
Bệnh viện C Thái Nguyên: Nghiên cứu và ứng dụng khoa học, kỹ thuật trong công tác khám, chữa bệnh

Bệnh viện Lao và bệnh Phổi Thái Nguyên nỗ lực vượt mọi khó khăn trong khám và điều trị bệnh

Trung tâm Y tế thị xã Phổ Yên: Nơi người bệnh gửi gắm niềm tin

Bệnh viện A Thái Nguyên: Nỗ lực, cống hiến, vì sức khỏe nhân dân

Trung tâm y tế huyện Đồng Hỷ: Nâng cao chất lượng chăm sóc và bảo vệ sức khỏe nhân dân
Trung tâm Y tế Chợ Đồn (Bắc Kạn): Không ngừng đổi mới, nâng cao chất lượng khám chữa bệnh