Vắc-xin Covid-19 Sinopharm được Bộ Y tế Việt Nam kiểm định nghiêm ngặt; đã được WHO khuyến cáo, sử dụng trên 59 quốc gia
Việt Nam tuân thủ theo hướng dẫn của WHO
Phó Viện trưởng Viện Kiểm định Quốc gia vắc-xin và sinh phẩm y tế (Bộ Y tế) Nguyễn Hoàng Tùng cho biết, vắc-xin Sinopharm đã được cấp số đăng ký lưu hành giống như các vắc-xin phòng Covid-19 khác trong trường hợp khẩn cấp và có điều kiện do Bộ Y tế ban hành tại quyết định số 7929/QĐ-BYT ngày 8/7.
Theo đó, vắc-xin này đã được Tổ chức Y tế Thế giới (WHO) tiền thẩm định và nằm trong hệ thống COVAX Facility nên việc kiểm định của Việt Nam cũng tuân thủ theo hướng dẫn của WHO dành cho vắc-xin phòng Covid-19 trong trường hợp khẩn cấp.
Việc kiểm định chất lượng bao gồm nhiều nội dung: Đánh giá hồ sơ sản xuất, mẫu của lô sản phẩm, giấy phép xuất xưởng NRA của nước sở tại, giấy chứng nhận phân tích COA của nhà sản xuất, đánh giá dây chuyền bảo quản lạnh trong quá trình nhập và vận chuyển vắc-xin (để cấp giấy chứng nhận xuất xưởng lô trước khi lưu hành)...

Vắc-xin Sinopharm đã được Bộ Y tế kiểm định nghiêm ngặt, cấp phép sử dụng cho người từ 18 tuổi trở lên
Quy trình kiểm định vắc-xin Covid-19 diễn ra thế nào?
- Đơn vị gửi mẫu kiểm định, gửi hồ sơ tóm tắt của lô vắc-xin cần kiểm định.
- Nhân viên Khoa Xuất xưởng kiểm tra cảm quan dây chuyền lạnh vắc-xin và sinh phẩm, đối chiếu số đăng ký của sản phẩm hoặc công văn cho phép của Cục Quản lý Dược, Bộ Y tế. Cán bộ chuyên trách giao mẫu kiểm định cho các khoa kiểm định chất lượng để thử nghiệm vắc-xin trong vòng 24 giờ.
- Khoa Xuất xưởng xét hồ sơ ngay kể từ ngày nhận. Trường hợp phát hiện hồ sơ chưa đạt yêu cầu phải báo cáo ngay với Trưởng khoa để xem xét, liên hệ với đơn vị gửi mẫu để bổ sung hoặc giải trình.
Nếu đơn vị gửi mẫu không trả lời, giải trình theo thời gian quy định, Viện sẽ trả lời lô vắc-xin không đạt yêu cầu.
- Khi nhận được mẫu từ Khoa Xuất xưởng, Khoa Kiểm định chất lượng triển khai ngay các thử nghiệm theo quy định và tuân thủ theo thời gian được chỉ đạo bởi lãnh đạo Viện.
Trong quá trình thử nghiệm, nếu phát hiện sự cố, cần chuyển lại ngay cho Khoa Xuất xưởng và trình lãnh đạo xem xét.
- Sau khi hoàn tất, cán bộ Khoa Xuất xưởng nhận lại kết quả kiểm định, so sánh với kết quả kiểm định của nhà sản xuất (nếu có) và rà soát lại hồ sơ, bằng chứng dây chuyền lạnh. Nếu tất cả kết quả đều đạt, chuẩn bị sẵn 3 bản gốc giấy chứng nhận xuất xưởng vắc xin, phiếu kết quả phân tích theo mẫu.
Trường hợp không đạt cũng tương tự, ngoài in mẫu chứng nhận không đạt, cần soạn công văn gửi Cục Quản lý Dược về kết quả lô không đạt.
Trong kết luận của giấy chứng nhận xuất xưởng phải ghi rõ lô vắc-xin đạt yêu cầu về nội dung nào, theo tiêu chuẩn nào.
Trong quá trình kiểm định, nếu cán bộ Khoa Kiểm định chất lượng có thắc mắc về thử nghiệm, có thể trực tiếp tiếp xúc với hồ sơ đăng ký, hồ sơ lô khi được Trưởng khoa Xuất xưởng đồng ý, nhưng chỉ được xem tại chỗ, để tuân thủ nguyên tắc bảo mật.
Lãnh đạo Viện sau khi xem xét thấy hồ sơ đạt yêu cầu sẽ chuyển toàn bộ hồ sơ và giấy chứng nhận xuất xưởng đã phê duyệt cho văn thư đóng dấu. Sau đó chuyển tiếp hồ sơ, giấy chứng nhận đến Cục Quản lý Dược và Chương trình Tiêm chủng mở rộng quốc gia.
Việc kiểm định vắc-xin Sinopharm cũng giống như các vắc-xin Covid-19 khác trước đó đã về Việt Nam được tiến hành theo đúng quy trình nghiêm ngặt như trên. Đây là quy định bắt buộc.
Quy định chung cho kiểm định vắc-xin phòng Covid-19 của Bộ Y tế theo hướng dẫn của WHO là cấp chứng nhận xuất xưởng 48 giờ sau khi nhận được đầy đủ mẫu, hồ sơ lô, bằng chứng về dây chuyền lạnh đạt yêu cầu.
Tính đến thời điểm hiện tại, có 6 loại vắc-xin phòng Covid-19 gồm AstraZeneca, Sputnik V, Pfizer, Moderna, Sinopharm và Janssen đã được Bộ Y tế cấp phép sử dụng tại Việt Nam.
Bộ Y tế khẳng định, tất cả các vắc-xin được cấp phép và đưa về Việt Nam sử dụng đều đảm bảo an toàn và hiệu quả.
Tại Hội nghị trực tuyến của Bộ Y tế kết nối đến hơn 700 điểm cầu trong cả nước diễn ra sáng 2/8, khi nói về công tác tiêm chủng vắc-xin phòng Covid-19, Bộ trưởng Y tế Nguyễn Thanh Long nhấn mạnh: Không lựa chọn vắc-xin, có vắc-xin nào tiêm vắc-xin đó. Tất cả vắc-xin Bộ Y tế cấp phép sử dụng đều đã được Tổ chức Y tế Thế giới cấp phép và các nước đã sử dụng.
| Vắc-xin Vero Cell do Sinopharm phát triển và Beijing Institute of Biological Products Co., Ltd.,- Trung Quốc sản xuất, đã được cấp phép sử dụng tại 64 quốc gia, vùng lãnh thổ. Vắc-xin này đã được Tổ chức Y tế thế giới đưa vào danh sách sử dụng khẩn cấp. Đến nay, vắc-xin này đang sử dụng tại 59 quốc gia với khoảng 800 triệu liều đã được sử dụng. Tại Việt Nam, vắc-xin Vero Cell đã được Bộ Y tế phê duyệt có điều kiện cho nhu cầu cấp bách trong phòng, chống dịch Covid-19. |
HOÀNG MINH
Các tin khác

Thu hồi lô thuốc phổ biến điều trị phù nề sau chấn thương, bỏng

Giám sát chặt việc sản xuất thuốc thông qua nguyên tắc GMP

Thắt chặt quản lý thực phẩm chức năng

Danh sách thuốc giả không được kinh doanh, buôn bán, sử dụng

Thêm 750 loại thuốc, biệt dược gốc được cấp phép lưu hành

Đảm bảo cung ứng thuốc phòng chống dịch bệnh, thuốc điều trị cúm A

Kiểm soát chặt chẽ việc nhập khẩu thuốc Spravato và hạt cây có chứa chất ma túy

Mua thuốc trực tuyến an toàn của FPT Long Châu qua VNeID

Thủ tướng yêu cầu phát triển sản phẩm y học cổ truyền phục vụ khách du lịch
Đọc nhiều

Chiếc thẻ và cơn gió ngược của nghề báo

Khi Bí thư xã làm “Đại sứ OCOP” ở xã Tân Hòa, TP. Cần Thơ

Khẩn trương triển khai dự án Nhà máy điện mặt trời Sao Mai 1 tại Cần Thơ

Tự xưng "Phòng khám Thẩm mỹ Nội khoa", DMANH Beauty bị Sở Y tế Hà Nội “chỉ mặt” hoạt động không phép

Phú Thọ: Công ty xử lý môi trường bị xử phạt hơn 172 triệu đồng vì gây ô nhiễm môi trường
Videos
E-magazine Inforgraphic Video

Xã Ô Diên – Hà Nội: Bất cập từ bãi vật liệu xây dựng gây ô nhiễm môi trường và trách nhiệm quản lý tại địa bàn cơ sở

Cảnh báo hành vi giả danh cán bộ thuế, cơ quan thuế để lừa đảo
Phòng ngừa cháy nổ trong dịp Tết Nguyên đán

Bản tin tổng hợp số 8 tháng 11 của Tạp chí Sức khoẻ & Môi trường

Hà Nội (Q.Hà Đông) : Môi trường sống của người dân không được đảm bảo bởi những công trình vi phạm TTXD

Giải pháp giảm thiểu đốt ngoài trời, sử dụng thuốc bảo vệ thực vật trong nông nghiệp - Cơ hội từ GAHP

Ngành Thép hướng tới tiêu hao nguyên liệu thấp

Chính thức thông cầu phao tạm thay thế cầu Phong Châu (Phú Thọ)

Cách xử lý vệ sinh môi trường sau mùa bão lụt

Học viện Y – Dược học Cổ truyền Việt Nam trao quyết định cho 10 Phó Giáo sư
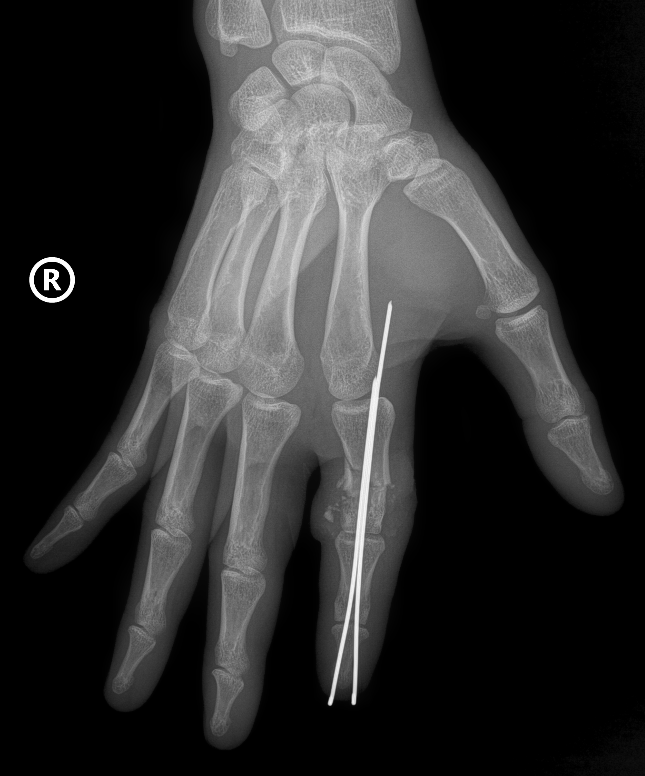
Vi phẫu thành công cứu sống ngón tay thủy thủ bị đứt rời sau 25 giờ

Công nghệ, khoa học mới mở rộng cơ hội sống cho bệnh nhân ung thư
Cảnh báo đột quỵ não ở trẻ: Ca bệnh đánh thức sự chủ quan

Trung tâm Y tế khu vực Yên Lạc tổ chức Hội thi “Phụ nữ với công tác Dân số và Phát triển” năm 2025

Chi cục An toàn thực phẩm tỉnh Phú Thọ: Nâng cao nhận thức trách nhiệm toàn xã hội về an toàn thực phẩm

Chi Cục An toàn thực phẩm Phú Thọ: Tập huấn tăng cường năng lực về quản lý an toàn thực phẩm cho Ban Chỉ đạo liên ngành ATTP xã, phường

Triển khai Hệ thống quản lý quốc gia về hành nghề và khám chữa bệnh

Hành trình khởi nghiệp của sinh viên Y Dược Cần Thơ

Bộ Y tế thu hồi dược liệu Ý dĩ không đạt tiêu chuẩn chất lượng

Bộ Y tế cấp mới, gia hạn giấy đăng ký lưu hành gần 800 loại thuốc

Gel Promed ngừa sẹo của Công ty Starmed bị đình chỉ lưu hành, thu hồi và tiêu hủy trên toàn quốc

Nguy cơ xâm nhập biến chủng Omicron vào Việt Nam là rất lớn

Giải pháp thích ứng với vi rút corona

Thủ tướng ký ban hành Nghị quyết về mua vắc-xin Covid-19

Rửa tay là biện pháp hàng đầu phòng bệnh tay chân miệng
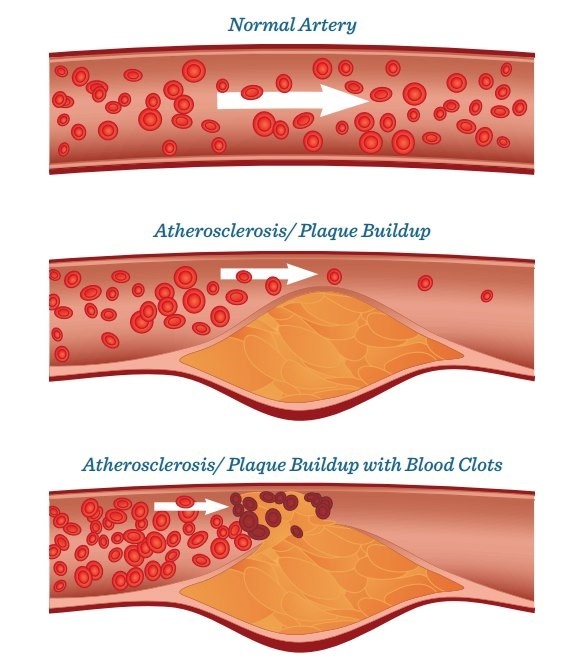
Phòng ngừa bệnh tim quá đơn giản: đánh răng!

Nữ thầy thuốc giỏi chuyên môn, nhiệt huyết với phong trào
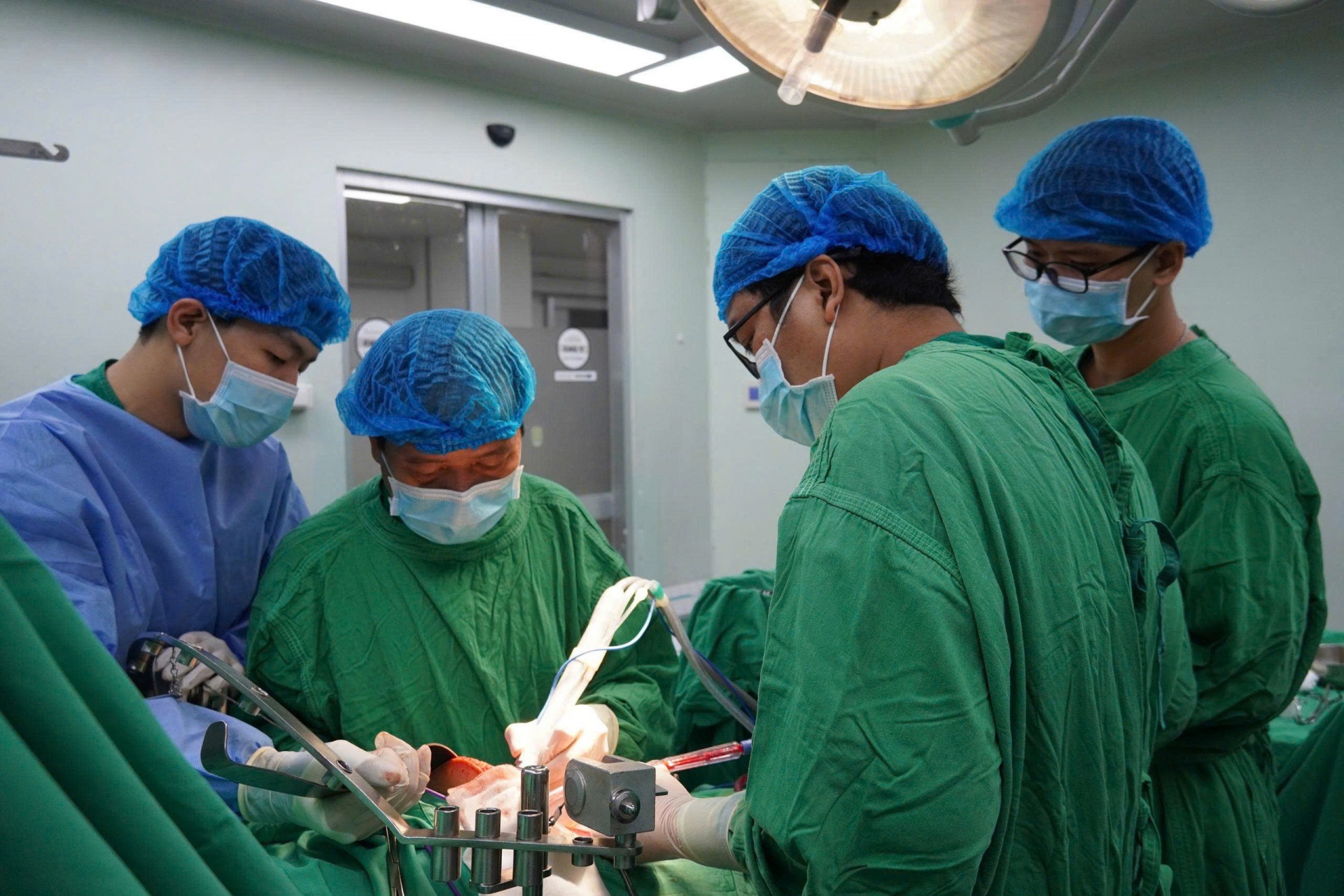
Bệnh viện Đa khoa Trung ương Cần Thơ: Sử dụng hệ thống dao mổ siêu âm Cusa trong phẫu thuật cắt gan

Tiến sĩ, bác sĩ, Thầy thuốc Nhân dân Trương Tấn Minh luôn hết lòng vì sự nghiệp y tế

Không để tình trạng ứng phó thụ động, bất ngờ với COVID-19

An Giang tăng cường kiểm soát, ngăn chặn bệnh cúm gia cầm

Bộ Y tế đã cấp phép, gia hạn hơn 13.500 số đăng ký thuốc, vaccine, sinh phẩm

BVĐK tỉnh Khánh Hoà: Điều trị thành công ca rò động mạch cảnh xoang hang bằng kỹ thuật can thiệp nội mạch thần kinh
Nổi bật

Chủ tịch Quốc hội Trần Thanh Mẫn: Đặt lợi ích người dân làm trung tâm trong công tác quy hoạch

Du lịch nâng tầm giá trị làng nghề, hướng tới mô hình phát triển bền vững

HUBT thành lập Hội đồng trường theo Luật Giáo dục đại học

Herbalife Việt Nam được trao giải thưởngTrách Nhiệm Xã Hội Doanh Nghiệp của AmCham lần thứ tám liên tiếp

Sơn La: Vùng núi cao rét đậm, có khả năng xảy ra băng giá từ đêm 13/12

Hơn 30 chuyên gia từ Mỹ và Anh khám từ thiện cho bệnh nhân nghèo

TTYT huyện Yên Lạc: Đẩy mạnh cải cách hành chính hướng tới sự hài lòng người bệnh
Bệnh viện C Thái Nguyên: Nghiên cứu và ứng dụng khoa học, kỹ thuật trong công tác khám, chữa bệnh

Bệnh viện Lao và bệnh Phổi Thái Nguyên nỗ lực vượt mọi khó khăn trong khám và điều trị bệnh

Trung tâm Y tế thị xã Phổ Yên: Nơi người bệnh gửi gắm niềm tin

Bệnh viện A Thái Nguyên: Nỗ lực, cống hiến, vì sức khỏe nhân dân

Trung tâm y tế huyện Đồng Hỷ: Nâng cao chất lượng chăm sóc và bảo vệ sức khỏe nhân dân
Trung tâm Y tế Chợ Đồn (Bắc Kạn): Không ngừng đổi mới, nâng cao chất lượng khám chữa bệnh