Vắc-xin Nanocovax được Hội đồng Đạo đức thông qua
(SK&MT) – Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia đã thông qua kết quả nghiên cứu giai đoạn 3 vắc-xin Covid-19 Nanocovax của Việt Nam.
Ngày 18/9, Hội đồng Đạo đức trong nghiên cứu y sinh học quốc gia tiếp tục họp thẩm định kết quả thử nghiệm lâm sàng giữa kỳ giai đoạn 3 của vắc-xin Nanocovax. Trước đó, nhà sản xuất và nhóm nghiên cứu vắc-xin đã hoàn thiện, bổ sung hồ sơ về thử nghiệm lâm sàng và đăng ký vắc-xin.
Theo trình tự, các kết quả nghiên cứu thử nghiệm lâm sàng Nanocovax tiếp tục được gửi cho Hội đồng tư vấn cấp giấy đăng ký thuốc, nguyên liệu làm thuốc để xem xét cấp phép khẩn cấp.
Trước đó, ngày 29/8 của Hội đồng Đạo đức, nhóm nghiên cứu đã bổ sung các dữ liệu để đủ điều kiện xem xét cấp phép khẩn cấp. Trong đó, có bổ sung về dữ liệu tính an toàn, sinh miễn dịch, hiệu quả bảo vệ. Trong đó, về tính sinh miễn dịch, nhóm nghiên cứu bổ sung, cập nhật đánh giá tính sinh miễn dịch trên các biến chủng mới như biến chủng Delta…
Việc được thông qua hồ sơ nghiên cứu thử nghiệm lâm sàng là yêu cầu quan trọng, để Hội đồng Đạo đức và Hội đồng Tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc (Hội đồng Cấp phép) đánh giá khả năng cấp phép cấp bách cho vắc-xin này.

Vaccine Nanocovax/Ảnh minh họa/Bộ Y tế.
Nanocovax là vắc-xin Covid-19 do Công ty Nanogen nghiên cứu, phát triển, một liệu trình hai liều tiêm cách nhau 28 ngày. Vắc-xin được đưa vào thử nghiệm lâm sàng ba giai đoạn bắt đầu từ 17/12/2020.
Giai đoạn 1 nghiên cứu trên 60 người tình nguyện từ 18 đến 50 tuổi, gồm 3 mức liều 25 mcg; 50 mcg và 75 mcg. Mỗi mức liều có 20 người tham gia, kéo dài từ tháng 12/2020 đến tháng 7/2021, mục tiêu đánh giá tính an toàn và thăm dò tính sinh miễn dịch của vắc-xin.
Giai đoạn 2 nghiên cứu trên 560 người tình nguyện từ 18 tuổi trở lên, gồm 4 nhóm: tiêm giả dược (placebo) 80 người; 3 nhóm tiêm vaccine với 3 mức liều 25 mcg; 50 mcg và 75 mcg, mỗi mức liều 160 người). Giai đoạn này tiếp tục đánh giá tính an toàn và tính sinh miễn dịch của vắc-xin để chọn được liều tối ưu sử dụng trong thử nghiệm lâm sàng giai đoạn 3. Thử nghiệm lâm sàng giai đoạn 2 bắt đầu từ tháng 2/2021 đến tháng 2/2022, khi có kết quả nghiên cứu giữa kỳ của giai đoạn một.
Ngày 11/6, ngay khi có kết quả đánh giá giữa kỳ giai đoạn 2, Bộ Y tế đã phê duyệt đề cương nghiên cứu thử nghiệm lâm sàng giai đoạn 3, thời gian nghiên cứu đến tháng 2/2023, với mục tiêu chính nhằm đánh giá tính an toàn và tính sinh miễn dịch của vắc-xin. Mức liều thử nghiệm ở giai đoạn này là 25 mcg, trên 13.000 người tình nguyện từ 18 tuổi trở lên.
Giai đoạn ba chia thành pha 3a và pha 3b, mục tiêu nghiên cứu là đánh giá tính an toàn, đáp ứng sinh miễn dịch và hiệu lực bảo vệ của ứng viên Nanocovax. Pha 3a có 1.000 người, tỷ lệ nhóm vắc-xin/placebo là 6:1. Pha 3b với 12.000 người, tỷ lệ nhóm vắc-xin/placebo là 2:1 thời gian nghiên cứu từ tháng 7/2021 đến tháng 2/2023, với mục tiêu chính nhằm đánh giá tính an toàn và hiệu lực bảo vệ của vắc-xin.
Ngày 10/9, vắc-xin đã hoàn thành tiêm thử nghiệm cho người tình nguyện ở cả hai pha. Báo cáo giữa kỳ của pha 3a và 3b, các dữ liệu về kết quả trung hòa virus sống các chủng Delta xuất hiện lần đầu tại Ấn Độ và Alpha xuất hiện lần đầu tại Anh đã được gửi tới Bộ Y tế ngày 15/9.
PV
Các tin khác

Hệ thống phòng khám thẩm mỹ Cao Kim được ghi nhận “Tấm lòng vàng nhân đạo” trong buổi Lễ phát động Tháng nhân đạo 2023

Kỳ 2: Thông tin của bệnh nhân bị “đánh cắp” từ kho lưu trữ hồ sơ bệnh án như thế nào?

Làm rõ dư luận “nghi vấn bác sỹ đặt thủy tinh thể nhân tạo không rõ nguồn gốc cho bệnh nhân ở Cần Thơ”

Vĩnh Phúc: Rủi ro từ những dịch vụ thẩm mỹ

Trẻ hóa Nano Fiber - Dẫn đầu xu hướng xóa nhăn hiệu quả bền vững tại Việt Nam

Phòng khám đa khoa Tâm Đức: Địa chỉ chăm sóc sức khỏe tin cậy

Tăng cường biện pháp đảm bảo an toàn thực phẩm đối với bếp ăn tập thể
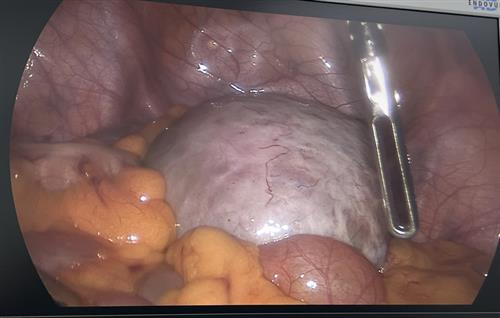
Phẫu thuật nội soi bóc khối u nang buồng trứng xoắn và bảo tồn thành công buồng trứng cho bệnh nhân
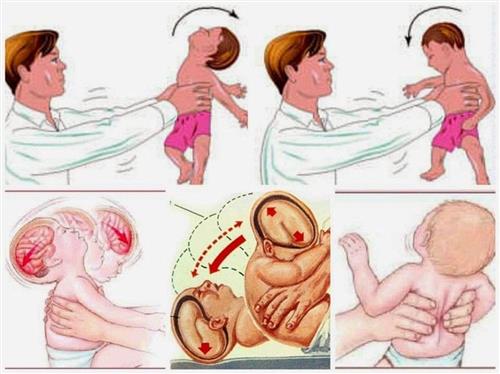
Cứu sống trẻ 4 tháng tuổi bị chảy máu não do hội chứng rung lắc
Đọc nhiều

Xã Bình Xuyên (Phú Thọ): Hành trình mới với khát vọng phát triển toàn diện

Thỏa thuận hợp tác bị hủy vẫn được tòa sơ thẩm công nhận có giá trị liệu có đúng luật?

Ông Trần Duy Đông làm Chủ tịch UBND tỉnh Phú Thọ mới

Bệnh viện Quân y 121, Quân khu 9 gặp mặt các cơ quan báo chí nhân ngày báo chí cách mạng Việt Nam

Đảng bộ xã Cờ Đỏ (Cần Thơ): Đoàn kết - Kỷ cương - Đổi mới - Phát triển

IVF Mỹ Đức Buôn Ma Thuột mang đến cơ hội làm cha, làm mẹ cho hơn 500 gia đình
Bệnh viện Đa khoa TW Cần Thơ, khẳng định vị thế trong điều trị y tế vùng ĐBSCL

Bệnh viện Đa khoa Khánh Hoà thành lập “Khoa Đột quỵ “

Công an tỉnh Vĩnh Long hưởng ứng ngày hội hiến máu tình nguyện
Trách nhiệm và tự hào khi hiến máu cứu người

TP. Hồ Chí Minh: Trung tâm thể dục sức khỏe quốc tế đầu tiên tại Việt Nam dành riêng cho người lớn tuổi

Chủ động phòng bệnh và theo dõi sức khỏe trong mùa hè

Vĩnh Phúc kiểm soát hiệu quả mất cân bằng giới tính khi sinh

Gel Promed ngừa sẹo của Công ty Starmed bị đình chỉ lưu hành, thu hồi và tiêu hủy trên toàn quốc

Tạm dừng lưu thông viên sủi Apiroca-B quảng cáo bổ sung vitamin nhóm B

Hướng dẫn thu hồi, xử lý thuốc vi phạm

Thu hồi lô thuốc phổ biến điều trị phù nề sau chấn thương, bỏng

Nguy cơ xâm nhập biến chủng Omicron vào Việt Nam là rất lớn

Giải pháp thích ứng với vi rút corona

Thủ tướng ký ban hành Nghị quyết về mua vắc-xin Covid-19

Rửa tay là biện pháp hàng đầu phòng bệnh tay chân miệng
Bệnh viện Đa khoa Trung ương Cần Thơ: Sử dụng hệ thống dao mổ siêu âm Cusa trong phẫu thuật cắt gan

Tiến sĩ, bác sĩ, Thầy thuốc Nhân dân Trương Tấn Minh luôn hết lòng vì sự nghiệp y tế

Tôn vinh những chiến sỹ áo trắng trên mặt trận vì sức khỏe nhân dân

BS Trần Hồng Vinh: 30 năm say mê nghiên cứu để chữa bệnh cứu người

Không để tình trạng ứng phó thụ động, bất ngờ với COVID-19

An Giang tăng cường kiểm soát, ngăn chặn bệnh cúm gia cầm

Bộ Y tế đã cấp phép, gia hạn hơn 13.500 số đăng ký thuốc, vaccine, sinh phẩm

BVĐK tỉnh Khánh Hoà: Điều trị thành công ca rò động mạch cảnh xoang hang bằng kỹ thuật can thiệp nội mạch thần kinh
Nổi bật

Thủ tướng: Biến Phong trào "Toàn dân bảo vệ an ninh Tổ quốc" thành sức mạnh vĩ đại giữ gìn non sông gấm vóc Việt Nam muôn đời bền vững

Tổng Bí thư: Trí thức, nhà khoa học, văn nghệ sĩ tiếp tục là lực lượng tiên phong mở đường cho dân tộc tiến lên mạnh mẽ

Đại hội Đảng bộ phường Ô Môn (TP Cần Thơ) lần thứ I, nhiệm kỳ 2025 - 2030
Nhau cài răng lược – một biến chứng sản khoa nguy hiểm
Đã uống rượu bia không nên tắm biển

Hơn 30 chuyên gia từ Mỹ và Anh khám từ thiện cho bệnh nhân nghèo

TTYT huyện Yên Lạc: Đẩy mạnh cải cách hành chính hướng tới sự hài lòng người bệnh
Bệnh viện C Thái Nguyên: Nghiên cứu và ứng dụng khoa học, kỹ thuật trong công tác khám, chữa bệnh

Bệnh viện Lao và bệnh Phổi Thái Nguyên nỗ lực vượt mọi khó khăn trong khám và điều trị bệnh

Trung tâm Y tế thị xã Phổ Yên: Nơi người bệnh gửi gắm niềm tin

Bệnh viện A Thái Nguyên: Nỗ lực, cống hiến, vì sức khỏe nhân dân

Trung tâm y tế huyện Đồng Hỷ: Nâng cao chất lượng chăm sóc và bảo vệ sức khỏe nhân dân
Trung tâm Y tế Chợ Đồn (Bắc Kạn): Không ngừng đổi mới, nâng cao chất lượng khám chữa bệnh